Granação: O caminho das folhas até os frutos
Granação: O caminho das folhas até os frutos.
Introdução
O ciclo do cafeeiro arábica adulto é dividido em seis fases fenológicas, dentre elas, a granação.
A granação normalmente ocorre de janeiro a março e compreende a fase onde os líquidos internos dos frutos solidificam-se (Camargo & Camargo, 2001), ocorrendo o preenchimento do endosperma e a formação dos grãos (popularmente conhecido como “enchimento de grãos”).
Apesar dos frutos serem verdes, possuírem estômatos e representar de 20 a 30% da superfície fotossintética total (Cannell, 1985), eles não produzem açúcares suficientes para seu crescimento e desenvolvimento, ou seja, são órgãos drenos (importadores).
Estima-se que os frutos produzem em torno de 30% de suas demandas diárias (para respiração) e contribuem com cerca de 12% de suas necessidades totais de carbono no estágio de enchimento do endosperma (Vaast et al., 2005). Assim, como os frutos são os drenos preferenciais de fotossintatos durante o período reprodutivo (Rena & Maestri, 1985), eles dependem do suprimento de açúcares, aminoácidos e alguns nutrientes pelas folhas fontes (folhas maduras e exportadoras).
As folhas maduras são órgãos especializados na realização da fotossíntese e até 80% do carbono fixado nesse processo pode ser exportado por elas (Lemoine et al., 2013). No entanto, as folhas e os frutos são interconectados pelo floema. Desse modo, o fluxo de açúcares, aminoácidos e nutrientes das folhas fontes para os frutos é dependente do processo de carregamento, translocação e descarregamento do floema, influenciando diretamente o componente de produtividade ‘peso de grãos por fruto’.
No cafeeiro, a sacarose é o principal açúcar translocado no floema (Franck et al., 2006; Geromel et al., 2008).
A sacarose é produto da fotossíntese, como ilustrado na Figura 01. Além disso, glutamina, glutamato, aspartato e asparagina são os aminoácidos mais translocados em geral (Tegeder & Rentsch, 2010). Também há translocação de alguns nutrientes no floema que, de acordo com suas funções fisiológicas, são classificados como: móveis (nitrogênio, fósforo, potássio e magnésio), moderadamente móveis (enxofre, cloro, molibdênio e zinco), pouco móveis (cobre, ferro e manganês) e quase imóveis (cálcio e boro).
Carregamento do floema*
* texto adaptado de Lemoine et al. (2013)
A partir da fotossíntese os açúcares podem ser armazenados no vacúolo, convertidos em amido ou sacarose (Figura 2). A parcela convertida em sacarose passa de célula a célula através de canais responsáveis pela conexão entre células vizinhas (plasmodesmos) até chegar nas células do parênquima do floema.
Importante: Diferentemente do xilema, o floema é um tecido vascular composto por células vivas, chamadas elementos de tubo crivado. No entanto, os elementos de tubo crivado não possuem núcleo e dependem de uma célula companheira para manterem-se vivos.

Figura 1. Esquema resumido da interação entre fotossíntese, carregamento e descarregamento do floema.
1) A luz azul e vermelha são absorvidas pelas clorofilas a e b e permitem a ocorrência da cadeia transportadora de elétrons nos cloroplastos, oxidando H2O e produzindo O2, ATP e NADPH. 2) Devido ao potencial hídrico adequado ocorre a transpiração e trocas gasosas através dos estômatos abertos, onde há saída dos gases H2O e O2 além da entrada de CO2. 3) A partir da disponibilidade de CO2, ATP e NADPH são sintetizados trioses (açúcares com 3 carbonos) como resultado do ciclo de Calvin (nos cloroplastos). As trioses se ligam para a formação de sacarose (açúcar com 12 carbonos). 4) A sacarose é o principal açúcar carregado no floema, gerando alta diferença de concentração entre a fonte e o dreno. 5) A sacarose é transportada no floema de forma pressurizada até o dreno, onde ocorre o descarregamento do floema. Nessa etapa a sacarose pode ser quebrada enzimaticamente em hexoses (glicose + frutose), há absorção, a fonte de carbono pode ser armazenada ou respirada para promover o crescimento e desenvolvimento do fruto.
A sacarose é então transportada para fora da célula do parênquima do floema através de transportadores. Assim, a sacarose fica no ‘espaço extracelular’ entre as células do parênquima do floema e as células companheiras (apoplasto). Após, a sacarose é absorvida e acumulada na célula companheira por um transportador simporte (H+ / sacarose).
A energia necessária para o transporte é fornecida por bombas de H+ que, a partir da quebra do ATP, formam um gradiente de H+ e estabelecem uma diferença de potencial eletroquímico transmembrana. Por fim, plasmodesmos permitem a passagem da sacarose das células companheiras para os elementos de tudo crivado (Figura 2).
Um esquema semelhante ocorre também com o carregamento dos aminoácidos (ver mais em Tegeder, 2014).
Translocação no floema
A translocação de materiais no floema é explicada pela teoria do fluxo de massa, proposta pelo pesquisador alemão Ernst Münch em 1930. Esta teoria considera que os movimentos se devem à existência de um gradiente de concentração de sacarose (ou outro açúcar), estabelecidas entre um órgão fonte e um órgão dreno. O acúmulo de sacarose nas células de elemento de tubo crivado pemitem a passagem da água do xilema (maior potencial hídrico) para o floema (menor potencial hídrico). No geral, estima-se que a concentração de sacarose no floema esteja em torno de 12 a 120 mg mL-1 de volume de floema (Kerbauy, 2004). Assim, uma alta pressão hidrostática é gerada nos elementos de tubo crivado (Figura 3). Os valores das taxas de transferência de massa podem variar entre 1 e 15 g h-1 cm-2 de elementos crivados (Taiz et al., 2017). Apesar da sacarose ser o principal agente na formação do gradiente osmótico ao longo do floema, o acúmulo de K+ no floema pode contribuir com esse processo (Pimentel, 1998).
 Figura 2. Carregamento do floema. Sacarose é produzida como resultado da fotossíntese em células do mesofilo, após se movem via plasmodesmos para as células do parênquima do floema. Transportadores carreiam a sacarose para o apoplasto. H+ é bombeado para o apoplasto a partir de bombas de H+ presentes na membrana de células companheiras. Esse processo necessita de energia fornecida por ATP, numa reação intermediada por Mg.
Figura 2. Carregamento do floema. Sacarose é produzida como resultado da fotossíntese em células do mesofilo, após se movem via plasmodesmos para as células do parênquima do floema. Transportadores carreiam a sacarose para o apoplasto. H+ é bombeado para o apoplasto a partir de bombas de H+ presentes na membrana de células companheiras. Esse processo necessita de energia fornecida por ATP, numa reação intermediada por Mg.
A sacarose entra na célula companheira através de um transportador simporte H+ / sacarose. Os transportadores dependem da diferença de potencial eletroquímico de H+ entre o lado externo e interno da membrana das células companheiras. Canais de K+ são capazes de regular essa diferença de potencial. A sacarose se movimenta através de plasmodesmos das células companheiras para os elementos de tubo crivado, elevando a concentração de sacarose nessas células. A alta concentração de sacarose no floema (menor potencial hídrico) atrai a água do xilema (maior potencial hídrico), essa entrada da água gera uma pressão hidrostática no floema e permite a movimentação de sacarose, aminoácidos e nutrientes do meio mais concentrado (próximo a fonte) para o menos concentrado (próximo ao dreno).

Figura 3. Visualização da exsudação da seiva do floema em abóbora (ilustração da pressão hidrostática). É possível verificar a exsudação da seiva do floema em plantas de abóbora ao fazer um corte no pecíolo. A aboboreira possui um sistema de carregamento do floema diferente do proposto para o cafeeiro, porém, também possui o mesmo princípio de translocação: a diferença de gradiente de açúcar e pressão hidrostática. Na aboboreira o principal açúcar encontrado no floema é a estaquiose carregado via simplasto. Para saber mais sugire-se o trabalho de Zhang et al. (2012). Foto: Lucas de Ávila Silva.
| Etapa | Descrição | |
|---|---|---|
| 1 | Fotossíntese | Os fotossintatos são sintetizados através da fotossíntese nas folhas |
| 2 | Síntese de açúcares de translocação | O fotossintato é convertido em açúcar de translocação (sacarose) |
| 3 | Carregamento | A sacarose é transportada ao floema por transportadores |
| 4 | Translocação | A sacarose flui de acordo com a concentração (da alta para baixa concentração de açúcar), de acordo com a teoria do fluxo de pressão |
| 5 | Descarregamento | A sacarose translocada até o fruto é descarregada a partir do floema |
| 6 | Transporte da membrana | A sacarose descarregada é absorvida pelas células através de transportadores na membrana plasmática (ou convertida em hexoses para absorção) |
| 7 | Conversão metabólica | A sacarose descarregada nos frutos é convertida em demais metabólitos e parte metabolizada para promover o crescimento |
| 8 | Compartimentalização | Os açúcares nas células podem ser compartimentados nos vacúolos ou armazenados como amido em amiloplastos |
Transporte de açúcares e seu papel na produtividade e qualidade do café
Muito se discute no campo sobre a importância da granação para melhorar o componente de produtividade ‘peso de grãos por fruto’. Entretanto, além de enchimento, é importante lembrar que os açúcares juntamente com os aminoácidos e nutrientes importados das folhas pelos frutos via floema também são a matéria prima para os todos os componentes relacionados a qualidade. As melhores bebidas vêm de frutos com maiores teores de sólidos solúveis totais (Amorim, 1972).
A sacarose é um dos compostos do grão de café cru que tem sido considerado um precursori mportante do sabor e aroma do café, formando anidro-açúcares e glioxal durante a torrefação, por exemplo (De Maria et al., 2014). Esses metabólitos são capazes de reagir com aminoácidos e formar compostos voláteis e não-voláteis essenciais para o sabor do café (Grosch, 2001; Homma, 2001). O conteúdo de sacarose nos grãos verdes de café arábica podem variar de 3,8% a 11,1% da matéria seca (Ky et al., 2001; Campa et al., 2004), sendo, portanto, determinante direta- e indiretamente da qualidade de bebida.
Granação: perspectivas em relação a genética e nutrição do cafeeiro
A capacidade do dreno de mobilizar fotossintatos (intensidade do dreno) depende de dois fatores: biomassa total do dreno (tamanho do dreno) e a taxa de absorção de fotossintatos por unidade de biomassa do dreno (atividade do dreno) (Taiz et al., 2017). Sabe-se que o fruto é o dreno preferencial do cafeeiro, no entanto, esforços genéticos e nutricionais podem melhorar a produtividade e qualidade final dos frutos.
Um exemplo de sucesso é o aumento do grau Brix do tomate, onde pesquisadores conseguiram identificar um gene relacionado a atividade da enzima invertase no apoplasto (descarregamento do floema) a fim de aumentar a concentração de açúcares do tomate, melhorando sua qualidade (melhor descrito em Omena-Garcia et al., 2019).
Em relação a nutrição vegetal, acima foram abordados o papel protagonista de K e Mg na granação. Além desses, é importante realçar o papel do N e P (Figura 4). A deficiência de N e P leva à redução da fotossíntese, acúmulo de carboidratos nas folhas fonte, aumento da alocação de carbono nas raízes e maior relação raiz / parte aérea (Lemoine et al., 2013), portanto, privilegiando o dreno ‘sistema radicular’. Além disso, a dose de N que permite maior produtividade é aquela relacionada com o suprimento equilibrado de sacarose entre o dreno vegetativo e reprodutivo, sendo que o excedente de N pode favorecer o dreno vegetativo (formação de folhas / ramificações jovens) (de Ávila Silva et al., 2019). A deficiência de Ca também pode levar a menor translocação de açúcares no floema (Gossett et al., 1977).
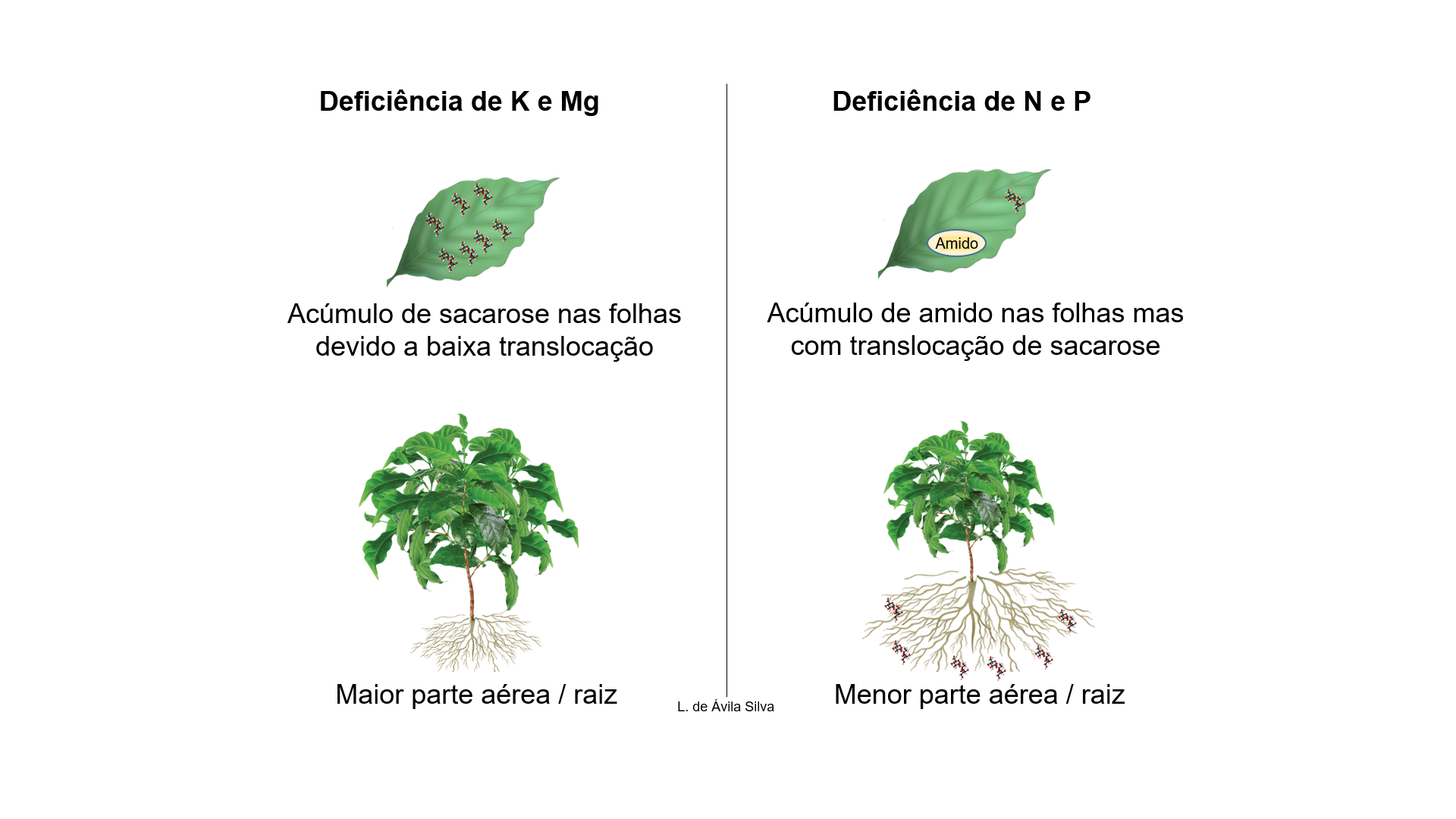
Figura 4. Padrão de acúmulo de açúcares e partição parte aérea / raiz. A deficiência de K e Mg leva ao acúmulo de sacarose (açúcar solúvel) nas folhas fonte, com menor exportação de sacarose para os drenos. Nesse caso, normalmente a parte aérea fica proporcionalmente maior do que o sistema radicular. Já a deficiência de N e P leva ao acúmulo de amido (açúcar insolúvel), mantendo a exportação de sacarose para os drenos. Nesse caso, normalmente a parte aérea fica proporcionalmente menor do que o sistema radicular. Apesar de alterarem a translocação do floema, não é comum verificar alterações na relação parte aérea / raiz com a deficiência de Ca, Zn e B.
Dentre os micronutrientes, aparentemente Zn e B são os mais relacionados com alterações fonte e dreno. Em plantas deficientes em Zn, o crescimento e a atividade do meristema apical (dreno vegetativo) decresce fortemente (Cakmak et al., 1989), além disso, carboidratos se acumulam nas folhas fonte (Marchner & Cakmak, 1989). Já em plantas deficientes em B, a translocação diminui drasticamente, em algumas espécies esse efeito pode estar relacionado com a deposição de calose nas placas crivadas, porém, em outras não (Van de Venter & Currier, 1977).
Portanto, a granação do cafeeiro é uma etapa fundamental para a produtividade e qualidade da bebida. A seleção de traços fisiológicos em programas de melhoramento relacionados a descarregamento de açúcares no fruto podem aprimorar sua qualidade. Ao mesmo tempo, a nutrição mineral do cafeeiro pode interferir no processo de granação, onde os nutrientes K, Mg, N, P, Ca, Zn e B atuam de forma direta. Há uma grande expectativa que pesquisas futuras possam melhorar nosso entendimento e melhorar o processo de granação do cafeeiro.
Por fim, é importante ressaltar que ainda há acúmulo de massa no fruto após o período de granação (Figura 5).

Bibliografia
Amaral, J. A., Da Matta, F. M., & Rena, A. B. (2001). Effects of fruiting on the growth of Arabica coffee trees as related to carbohydrate and nitrogen status and to nitrate reductase activity. Revista Brasileira de Fisiologia Vegetal, 13(1), 66-74.
Amorim, H. V. (1972) Relação entre alguns componentes orgânicos do grão do café verde com a qualidade da bebida. Piracicaba: ESALQ. 132 p. Tese de Doutorado.
Cakmak, I., Marschner, H., & Bangerth, F. (1989). Effect of zinc nutritional status on growth, protein metabolism and levels of indole-3-acetic acid and other phytohormones in bean (Phaseolus vulgaris L.). Journal of Experimental Botany, 40(3), 405-412.
Camargo, Â. P. D., & Camargo, M. B. P. D. (2001). Definição e esquematização das fases fenológicas do cafeeiro arábica nas condições tropicais do Brasil. Bragantia, 60(1), 65-68.
Campa, C., Ballester, J. F., Doulbeau, S., Dussert, S., Hamon, S., & Noirot, M. (2004). Trigonelline and sucrose diversity in wild Coffea species. Food chemistry, 88(1), 39-43.
Cannell MG (1985) Physiology of the coffee crop. In: Clifford MN, Willson KC (eds), Coffee – Botany, Biochemistry and Production of Beans and Beverage, pp.108-134. Crom Helm, London.
DaMatta, F. M., Ronchi, C. P., Maestri, M., & Barros, R. S. (2007). Ecophysiology of coffee growth and production. Brazilian journal of plant physiology, 19(4), 485-510. de Ávila Silva, L., Condori-Apfata, J. A., Marcelino, M. M., Tavares, A. C. A., Raimundi, S. C. J., Martino, P. B., … & Nunes-Nesi, A. (2019). Nitrogen differentially modulates photosynthesis, carbon allocation and yield related traits in two contrasting Capsicum chinense cultivars. Plant Science, 283, 224-237.
De Maria, C. A. B., Trugo, L. C., Moreira, R. F. A., & Werneck, C. C. (1994). Composition of green coffee fractions and their contribution to the volatile profile formed during roasting. Food Chemistry, 50(2), 141-145.
Franck, N., Vaast, P., Génard, M., & Dauzat, J. (2006). Soluble sugars mediate sink feedback down-regulation of leaf photosynthesis in field-grown Coffea arabica. Tree physiology, 26(4), 517-525.
Geromel, C., Ferreira, L. P., Davrieux, F., Guyot, B., Ribeyre, F., dos Santos Scholz, M. B., … & Androcioli Filho, A. (2008). Effects of shade on the development and sugar metabolism of coffee (Coffea arabica L.) fruits. Plant Physiology and Biochemistry, 46(5-6), 569-579.
Geromel, C., Ferreira, L. P., Guerreiro, S. M. C., Cavalari, A. A., Pot, D., Pereira, L. F. P., … & Marraccini, P. (2006). Biochemical and genomic analysis of sucrose metabolism during coffee (Coffea arabica) fruit development. Journal of Experimental Botany, 57(12), 3243-3258.
Gossett, D. R., Egli, D. B., & Leggett, J. E. (1977). The influence of calcium deficiency on the translocation of photosynthetically fixed 14C in soybeans. Plant and soil, 48(1), 243-251.
Grosch W. (2001). Volatile compounds. In: Clarke R.J., Vitzthum O.G., eds. Coffee: recent developments. Oxford: Blackwell Science, 68–89.
Homma S. (2001). Non-volatile compounds, part II. In: Clarke R.J., Vitzthum O.G., eds. Coffee: recent developments. Oxford: Blackwell Science, 50–67.
Kerbauy, G. B. (2004). Fisiologia vegetal (Vol. 7). Rio de Janeiro: Guanabara Koogan.
Ky, C. L., Louarn, J., Dussert, S., Guyot, B., Hamon, S., & Noirot, M. (2001). Caffeine, trigonelline, chlorogenic acids and sucrose diversity in wild Coffea arabica L. and C. canephora P. accessions. Food chemistry, 75(2), 223-230.
Laviola, B. G., Martinez, H. E. P., Souza, R. B. de & Alvarez V., V. H. (2007). Dinâmica de N e K em folhas, flores e frutos de cafeeiro arábico em três níveis de adubação. Bioscience Journal, 22(3).
Lemoine, R., La Camera, S., Atanassova, R., Dédaldéchamp, F., Allario, T., Pourtau, N., … & Faucher, M. (2013). Source-to-sink transport of sugar and regulation by environmental factors. Frontiers in plant science, 4, 272.
Marschner, H., & Cakmak, I. (1989). High light intensity enhances chlorosis and necrosis in leaves of zinc, potassium, and magnesium deficient bean (Phaseolus vulgaris) plants. Journal of Plant Physiology, 134(3), 308-315.
Omena-Garcia, R. P., de Ávila Silva, L., Vital, C. E., Araújo, W. L., Ramos, H. J., & Nunes-Nesi, A. (2019). Identification of metabolite traits from the current metabolomic approaches. Theoretical and Experimental Plant Physiology, 31(1), 1-19.
Pimentel, C. (1998). Metabolismo de carbono na agricultura tropical. Edur.
Rena, A. B. & Maestri, M. (1985) Fisiologia do cafeeiro. Inf. Agropec., 11:26-40.
Taiz, L., Zeiger, E., Møller, I. M., & Murphy, A. (2017). Fisiologia e desenvolvimento vegetal. Artmed Editora.
Tegeder, M. (2014). Transporters involved in source to sink partitioning of amino acids and ureides: opportunities for crop improvement. Journal of Experimental Botany, 65(7), 1865-1878.
Tegeder, M., & Rentsch, D. (2010). Uptake and partitioning of amino acids and peptides. Molecular Plant, 3(6), 997-1011.
Vaast, P., Angrand, J., Franck, N., Dauzat, J., Génard M. (2005) Fruit load and ring-barking affect carbon allocation and photosynthesis of leaf and fruit of Coffea arabica in the field. Tree Physiol 25:753-760.
Van de Venter, H. A., & Currier, H. B. (1977). The effect of boron deficiency on callose formation and 14C translocation in bean (Phaseolus vulgaris L.) and cotton (Gossypium hirsutum L.). American Journal of Botany, 64(7), 861-865.
Yamaki, S. (2010). Metabolism and accumulation of sugars translocated to fruit and their regulation. Journal of the Japanese Society for Horticultural Science, 79(1), 1-15.
Zhang, C., Yu, X., Ayre, B. G., & Turgeon, R. (2012). The origin and composition of cucurbit “phloem” exudate. Plant Physiology, 158(4), 1873-1882.





